CERTIFICACIÓN EN BUENAS PRÁCTICAS DE ELABORACIÓN, LABORATORIO Y MANUFACTURA INVIMA- DECRETO 335 DE 2022

Con este decreto el Ministerio de Salud y Protección Social establece un procedimiento unificado para los interesados en obtener los certificados de cumplimiento de las buenas prácticas de elaboración, laboratorio y manufactura ante el INVIMA, reduciendo los tiempos previstos para el desarrollo de estos trámites e incorporando nuevas herramientas para facilitar su desarrollo, como la posibilidad de realizar las visitas de certificación de forma presencial, virtual o mixta, logrando una mayor eficiencia en estos trámites.
El decreto también incorpora el análisis y gestión del riesgo en los hallazgos de las visitas de certificación, alineándose con estándares internacionales, lo que permite ampliar las opciones que se tienen frente al resultado de las visitas de estas certificaciones y de esta forma los establecimientos o instituciones puedan continuar desarrollando actividades para mantener la continuidad en la disponibilidad de los medicamentos para los usuarios que los requieren, asegurando su calidad, seguridad y eficacia.

Aplica para los siguientes establecimientos que requieran la certificación en Buenas Prácticas de elaboración, laboratorio y manufactura:
- Fabricantes y desarrolladores de medicamentos de síntesis química, biológicos, biotecnológicos, radiofármacos, antivenenos, homeopáticos, gases medicinales, productos fitoterapéuticos y suplementos dietarios.
- Laboratorios que realicen análisis de control de calidad de medicamentos, bien sea que pertenezcan al laboratorio fabricante o sean laboratorios externos que presten servicios de análisis de control de calidad.
- Los servicios y establecimientos farmacéuticos que realicen actividades de adecuación y ajuste de concentración de dosis, preparación de nutriciones parenterales, preparaciones magistrales, reempaque y reenvase de medicamentos.
- Las radiofarmacias que realicen actividades con radiofármacos o radionúclidos, juegos de reactivos, generadores, radiomarcación de muestras autólogas precursores, producción de radiofármacos con isótopos provenientes de aceleradores (ciclotrones), síntesis de radiofármacos para Tomografía por Emisión de Positrones (PET), marcación o síntesis de radiofármacos para terapia, para uso humano con fines médicos para ser administrados a pacientes de un servicio de medicina nuclear habilitado.
Requisitos generales para la solicitud del certificado de cumplimiento de buenas prácticas
Para solicitar y obtener el certificado de cumplimiento de buenas prácticas ante el INVIMA, se debe cumplir con los requisitos técnicos específicos para cada tipo de certificación y cumplir con lo siguiente:

Una vez radicada la solicitud, el INVIMA procederá a revisarla dentro de los quince (15) días hábiles para determinar si cumple con los requisitos establecidos.
Si se cumple con la totalidad de los requisitos el INVIMA incluirá el establecimiento en un cronograma de visitas de Certificación de Buenas Prácticas y en caso de no cumplir se le negará el trámite de solicitud.
Cuando sea aprobada la solicitud eI INVIMA programará la visita de certificación de cumplimiento de buenas prácticas en un plazo máximo de 90 días, que se contarán a partir de la fecha de aprobación de la solicitud, cuando sea por primera vez, se efectuará en máximo dos (2) meses, y de tres (3) meses en el caso de visitas de renovaciones.
El INVIMA podrá realizar las visitas de certificación de cumplimiento de las buenas prácticas, renovaciones y ampliaciones de manera presencial, virtual o mixta.
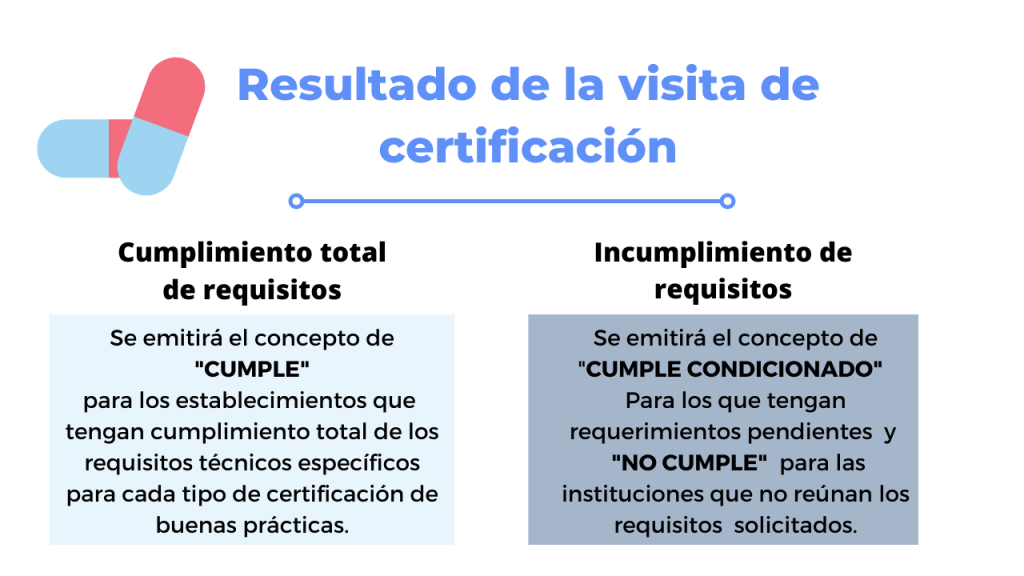
Una vez realizada la visita el INVIMA emitirá el concepto definitivo de «CUMPLE» o «NO CUMPLE«, en el caso de que se emita el concepto de «CUMPLE CONDICIONADO» se reprogramará la visita en un plazo máximo de dos (2) meses, contado a partir de la fecha en que el interesado solicite la verificación.
Sabes ¿Por qué es importante planear adecuadamente la matriz legal?
Aceptación de certificaciones de buenas prácticas de manufactura de otros paises para medicamentos importados

Los certificados de cumplimiento de buenas prácticas de manufactura, o sus equivalentes tendrán la vigencia que el mismo documento especifique. En caso de que el documento no establezca dicho término, este se entenderá de un (1) año desde la fecha de su expedición. No obstante, el INVIMA podrá realizar revisiones periódicas en las páginas web de las agencias sanitarias de otros países para verificar el estado de los mismos.
Vigencia del certificado de cumplimiento de las buenas prácticas
Este certificado de cumplimiento de las buenas prácticas, tendrá la vigencia que cada regulación especial haya establecido.
El titular de los registros sanitarios, durante la vigencia de los mismos debe contar con el certificado de buenas prácticas de manufactura vigente para los establecimientos involucrados en las etapas del proceso productivo.
Conoce cuál es la metodología para evaluar la matriz legal.
Sanciones por incumplimiento
El incumplimiento de las disposiciones establecidas en este decreto conllevará a que se apliquen las medidas sanitarias de seguridad de conformidad establecidas en la Ley 9 de 1979, además se impondrán las sanciones siguiendo el procedimiento contemplado en la Ley 1437 de 2011 o las normas que los modifiquen o sustituyan.
Los interesados que hayan radicado solicitudes de certificación, ampliación o renovación de las buenas prácticas antes de la publicación del presente decreto, podrán acogerse a lo dispuesto en el artículo 7 de la presente norma.

Descarga el decreto 335 de 2022 completo aquí.
ENLACES DE INTERÉS
¿Ya actualizaste tu matriz legal?
No gastes tu tiempo, disminuye la probabilidad de error (minimiza el riesgo), cuenta con el respaldo que necesitas en la interpretación de las normas; tu labor es más valiosa poniendo en práctica las actividades a realizar.
Elige la opción que más se ajuste a tus necesidades y las de tu organización👇
https://tienda.atcalsas.com/producto/matriz-de-requisitos-legales-para-micro-y-pequenas-empresas-2/


Inscríbete al curso aquí: https://bit.ly/3iE1E96







